Une nouvelle étude examine l’impact des règlements de l’UE sur l’impression 3D médicale

Le marché de l’impression 3D médicale a connu une croissance rapide ces dernières années. Cela inclut l’UE, où le marché global de la fabrication additive dans le secteur de la santé devrait croître à un taux annuel composé (CAGR) de 15,4 % jusqu’en 2029. Ce n’est pas surprenant quand on considère que l’Office européen des brevets a constaté l’année dernière que les familles de brevets internationaux dans les technologies d’impression 3D avaient augmenté à un taux annuel de 26,3 % , avec près d’un cinquième de ceux-ci réalisés entre 2001 et 2020 dans le secteur de la santé. Mais y a-t-il des facteurs qui ralentissent encore sa croissance?
De nouvelles recherches menées par le Dr Marc Mimler, maître de conférences en droit à The City Law School, semblent le suggérer. Dans l’article « Core Legal Challenges for Medical 3D Printing in the EU », Mimler, avec d’autres collaborateurs de différents hôpitaux universitaires ainsi que des départements de génie mécanique, il a cherché à examiner la législation et la jurisprudence de l’UE, relevant du Règlement sur les dispositifs médicaux (RDM), sur des questions liées à l’approbation préalable à la mise sur le marché et à la responsabilité après la mise sur le marché des dispositifs imprimés en 3D. Et les résultats semblent montrer que des zones grises dans ce domaine entravent effectivement la croissance de l’impression 3D médicale, avec plus de travail nécessaire pour clarifier les questions.
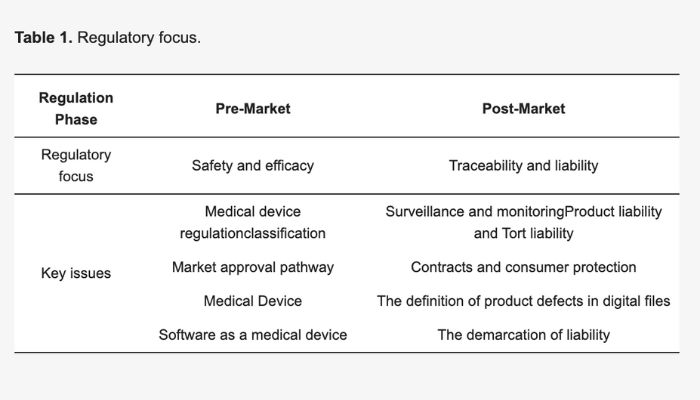
L’étude se concentre sur les réglementations pré-marché et post-marché pour les dispositifs médicaux imprimés en 3D (crédits image : Mimler et al.)
Les règlements de l’UE nuisent-ils à la croissance de l’impression 3D médicale?
Les résultats, comme détaillé dans un communiqué de presse de The City Law School, sont divisés en fonction du statut pré- et post-marché. En examinant les réglementations pré-marché, les chercheurs se sont concentrés sur « l’exemption pour dispositifs sur mesure » de l’UE, qui permet aux dispositifs fabriqués selon une description écrite par une personne autorisée de contourner des exigences telles que le marquage CE. Et bien que cela puisse sembler positif pour l’impression 3D, le fait que les dispositifs « adaptés aux patients » (qui ont été fabriqués pour un patient spécifique) ne relèvent pas de cette exemption crée une zone grise pour les dispositifs médicaux imprimés en 3D. Surtout que cette distinction n’est pas en place pour les dispositifs « personnalisés en masse ».
En conséquence, la conformité réglementaire est incertaine pour les dispositifs fabriqués par fabrication additive. Cette confusion est encore accentuée par le fait que, bien que la fabrication industrielle de dispositifs imprimés en 3D au sein des institutions de santé et des hôpitaux puisse relever de l’exemption des institutions de santé du RDM, cela ne s’applique pas aux autres entreprises. Cela rend difficile pour les institutions et les petites entreprises de naviguer dans le paysage réglementaire des dispositifs imprimés en 3D sur mesure.
Et cela ne concerne que l’approbation pré-marché, les réglementations post-marché semblent également être floues pour l’impression 3D dans le domaine de la santé. En raison de l’approche plus rigoureuse de l’UE en matière de surveillance et de contrôle des dispositifs médicaux après leur mise sur le marché, la responsabilité du produit pour les dispositifs imprimés en 3D n’est pas claire selon le RDM. Cela est dû à une frontière floue entre la négligence médicale et le produit.
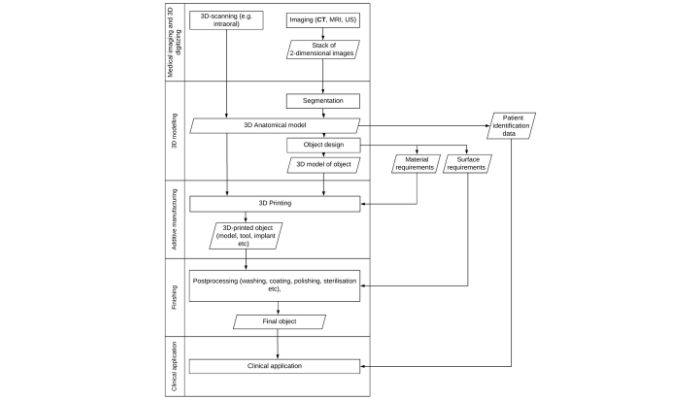
La nature décentralisée du processus pour les dispositifs médicaux imprimés en 3D (comme montré ci-dessus) peut causer confusion et problèmes pour les réglementations post-marché (crédits image : Mimler et al.)
Les auteurs soutiennent que cela freine l’innovation dans le domaine, car des parties telles que les chirurgiens, les fabricants tiers et les fabricants internes pourraient être tenus responsables de tout défaut après l’implantation d’un dispositif imprimé en 3D chez un patient. Et cette confusion est directement due au fait qu’il n’est pas clair qui est exactement le fabricant en raison de la nature décentralisée de l’impression 3D. L’incertitude concernant les lois sur la protection des données et la propriété intellectuelle ne fait que compliquer encore les choses.
En fin de compte, les chercheurs notent qu’il est important de réexaminer ce qu’ils considèrent comme des exigences conservatrices et ambiguës en vertu du RDM en ce qui concerne les dispositifs imprimés en 3D. Ils soutiennent qu’actuellement, le système freine l’innovation dans le domaine et retarde les soins aux nouveaux patients, car les acteurs peuvent ne pas être en mesure de naviguer dans le paysage réglementaire actuel pour les dispositifs sur mesure, et la documentation extensive ralentit également le temps de mise sur le marché. Vous pouvez en savoir plus dans l’article complet ICI.
Que pensez-vous de ces conclusions concernant les règlements de l’UE et l’impression 3D médicale? Partagez votre avis dans les commentaires de l’article. Retrouvez toutes nos vidéos sur notre chaîne YouTube ou suivez-nous sur Facebook ou LinkedIn !






