Les normes actuelles de la bio-impression 3D sont-elles éthiques ?

Dans le paysage en rapide évolution de la biotechnologie, la bio-impression est apparue comme une lueur d’espoir pour transformer les soins de santé et relever des défis médicaux cruciaux tels que la transplantation d’organes, l’ingénierie tissulaire, l’essai et le développement de médicaments, la médecine personnalisée, la régénération des nerfs, la modélisation des maladies, et bien d’autres encore. Pouvant révolutionner notre approche de la médecine moderne, la bio-impression attire de plus en plus l’attention des chercheurs, des investisseurs et des professionnels de la santé. Toutefois, à mesure qu’elle évolue rapidement, la bio-impression est soumise à l’examen critique de considérations éthiques, de cadres juridiques et de défis réglementaires.
Avec une croissance continue qui attire des investissements substantiels, la nécessité d’affronter et de traiter les complexités éthiques entourant cette technologie révolutionnaire devient de plus en plus pressante. Pour mieux comprendre cela, nous avons jeté un coup d’œil au cœur de l’industrie de la bio-impression, en explorant les préoccupations éthiques réelles qui découlent de la fabrication d’organes humains artificiels, y compris l’utilisation controversée de cellules souches embryonnaires humaines et les risques potentiels associés aux cellules souches pluripotentes induites, à la numérisation, aux essais cliniques et à l’expérimentation animale, entre autres.
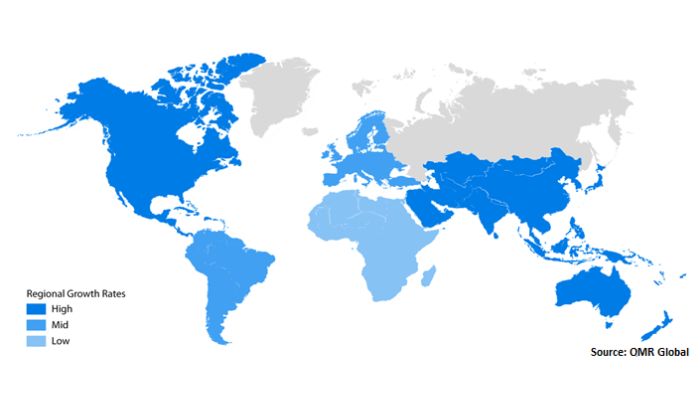
La taille du marché mondial de la bio-impression 3D était de 2,13 milliards en 2022 et devrait atteindre environ 8,3 milliards d’ici 2030 (crédits photo : OMR Global)
En plaçant la bio-impression sous le microscope, nous examinerons l’interaction complexe entre tout son potentiel et le besoin pressant d’une gouvernance responsable. En naviguant dans ces complexités, il est important de trouver l’équilibre délicat entre l’innovation et la responsabilité éthique, garantissant ainsi que l’avenir de la médecine progresse avec une conscience claire.
Lois et normes universelles en biomédecine
Pour comprendre les améliorations possibles, il est essentiel de se pencher sur les lois et les normes existantes. Dans le domaine de la biomédecine, ces réglementations forment un cadre global qui supervise les aspects médicaux et biologiques, les efforts de recherche et les innovations technologiques. Ces lois et normes jouent un rôle essentiel en garantissant la sécurité des patients, en tenant compte des considérations éthiques, en préservant l’intégrité de la recherche et en promouvant un progrès médical responsable. Ce cadre guide différents domaines, chacun ayant une orientation distincte.
Par exemple, les essais cliniques et l’éthique de la recherche jouent un rôle fondamental en supervisant l’engagement des sujets humains dans la recherche et les essais cliniques. Pendant ce temps, des organismes tels que les comités d’examen institutionnels (CEI) garantissent le consentement éclairé, la protection des droits des participants et le respect inébranlable de l’éthique. Simultanément, les agences gouvernementales de réglementation telles que la FDA assument la responsabilité de superviser l’ensemble de la trajectoire de la création de dispositifs médicaux. Les lois sur la confidentialité des données, telles que le GDPR et l’HIPAA, ne doivent pas être oubliées car elles sont de plus en plus importantes pour protéger le stockage et l’utilisation des données médicales sensibles. Dans le même ordre d’idées, la propriété intellectuelle doit également être prise en compte lorsqu’il s’agit d’innovations dans ce domaine.
L’une d’entre elles, particulièrement importante dans le domaine de la bio-impression, est la recherche sur les cellules souches, qui occupe un espace unique à l’intersection du progrès scientifique et des considérations éthiques, en définissant des limites admissibles qui incluent le domaine complexe des cellules souches embryonnaires. La transplantation d’organes, quant à elle, navigue entre le bien-être du patient et l’approvisionnement éthique en organes, favorisant un équilibre fondé sur l’équité et la responsabilité. Et bien sûr, il y en a beaucoup d’autres pour divers aspects des soins de santé, y compris la reproduction.
Collectivement, ces dimensions juridiques créent un paysage où le progrès biomédical peut s’épanouir. S’adaptant et évoluant dans diverses régions, les lois et les normes de la biomédecine doivent rester calibrées sur le paysage en constante évolution du progrès scientifique et des préoccupations sociétales. Cet équilibre dynamique garantit que les progrès médicaux sont poursuivis dans les limites d’une conduite responsable et éthique. Ainsi, la bio-impression n’est pas entièrement couverte mais peut être poursuivie dans le cadre de la législation de différents organismes.

Bien qu’il n’existe pas actuellement de réglementation complète pour encadrer l’ensemble du processus de bio-impression, il existe une législation partielle relative à l’ingénierie tissulaire et à la médecine régénérative (crédits photo : Walden University)
Les lois et les normes relatives à la bio-impression
Il est maintenant nécessaire d’examiner comment les lois sont appliquées directement au domaine en constante évolution de la bio-impression. En effet, la section « Normes universelles pour les produits issus de l’ingénierie tissulaire » de l’étude « Current standards and ethical landscape of engineered tissues-3D bioprinting perspective« , publiée par PubMed Central, traite de l’importance des normes universelles pour les produits médicaux issus de l’ingénierie tissulaire (TEMP) afin de garantir une qualité constante dans le monde entier. Ces normes sont établies par des organisations telles que l’Organisation internationale de normalisation (ISO) et l’American Society for Testing and Materials (ASTM) International.
En fait, l’ASTM et l’ISO ont toutes deux publié une liste de normes pour les TEMP, couvrant divers aspects tels que la classification, les biomatériaux, les constructions cellulaires et tissulaires, la sécurité et les évaluations. Ces normes contribuent à réglementer et à garantir la sécurité et la qualité des produits issus de l’ingénierie tissulaire, de la recherche préclinique aux essais cliniques. En outre, l’ISO a collaboré avec divers organismes et experts pour améliorer en permanence les normes et la qualité à l’échelle mondiale, en particulier pour les techniques de fabrication additive utilisées dans divers domaines, y compris la médecine.
Dans l’ensemble, ces normes universelles jouent un rôle crucial dans la validation des produits médicaux, y compris les produits issus de l’ingénierie tissulaire, et garantissent leur sécurité et leur efficacité pour l’utilisation humaine. La bio-impression étant un domaine qui évolue rapidement, les normes et les organisations impliquées dans la définition de ces normes se développent continuellement. Bien que les normes spécifiques puissent varier, il existe des tendances et des aspects généraux liés aux normes en matière de bio-impression, qui concernent :
- Normes relatives aux matériaux : Il est nécessaire de disposer de biomatériaux normalisés compatibles avec les processus de bio-impression et sûrs pour une utilisation avec des cellules vivantes. Les matériaux utilisés doivent avoir des propriétés mécaniques, une biocompatibilité et des taux de dégradation appropriés. Des efforts sont constamment déployés pour établir des normes relatives à la qualité et aux caractéristiques des bio-encres et des matériaux d’échafaudage.
- Viabilité et fonctionnalité des cellules : Des normes sont en cours d’élaboration pour garantir que les structures bio-imprimées conservent la viabilité et la fonctionnalité des cellules. Les processus de bio-impression ne doivent pas compromettre la viabilité et le comportement des cellules incorporées, leur permettant de croître, de se différencier et de remplir les fonctions prévues.
- Imprimabilité et résolution : Des lignes directrices sont à l’étude pour la conception et l’impression de structures complexes. Les facteurs d’imprimabilité, tels que la résolution, l’épaisseur de la couche et le diamètre de la buse, doivent être normalisés pour garantir la précision et la reproductibilité des constructions bioprintées.
- Culture en bioréacteur : Les structures bio-imprimées en 3D nécessitent souvent une culture post-impression dans des bioréacteurs. Des normes sont envisagées pour les conditions de culture, notamment la température, l’humidité, l’apport en nutriments et la stimulation mécanique, afin de favoriser une croissance cellulaire et un développement tissulaire optimaux.
- Contrôle de la qualité et caractérisation : Il est essentiel de disposer de méthodes normalisées pour le contrôle de la qualité et la caractérisation des structures bio-imprimées. Il s’agit notamment d’évaluer la viabilité cellulaire, la distribution des cellules, la morphologie des tissus, les propriétés mécaniques et la fonctionnalité.
- Considérations éthiques et réglementaires : La bio-impression implique de travailler avec des cellules et des tissus vivants, ce qui soulève des questions d’ordre éthique et réglementaire. Des normes sont à l’étude pour garantir l’utilisation responsable et sûre des technologies de bio-impression, en abordant les questions liées à la sécurité des patients, au consentement et à la propriété intellectuelle.
- Calibrage et validation de la bio-imprimante : Pour garantir la précision et la reproductibilité des processus de bio-impression, il faut des protocoles normalisés de calibrage et de validation des bio-imprimantes. Cela permet d’obtenir des résultats cohérents dans différents laboratoires et systèmes.
- Rapport et partage des données : La normalisation des rapports sur les processus, les matériaux et les résultats de la bio-impression est essentielle pour faciliter la collaboration, la reproductibilité et la comparaison des résultats de la recherche. Le partage ouvert des données et des méthodes peut accélérer les progrès dans ce domaine.
Disséquer le paysage réglementaire
À l’heure actuelle, la transformation clinique des tissus issus de l’ingénierie et de la bio-impression (TEMP) se heurte à d’importants obstacles. L’un des principaux problèmes est l’absence de réglementation mondiale normalisée pour les TEMP, ce qui nécessite des modifications des normes et réglementations actuelles. Les lignes directrices réglementaires varient d’une région à l’autre, ce qui rend difficile la traduction clinique cohérente de ces questions. Pour surmonter ces difficultés, de nombreux organismes de réglementation adoptent une approche adaptative dans l’approbation des TEMP, compte tenu de leur complexité et de leur manque de fiabilité dû à l’utilisation de biomatériaux et de cellules naturels. Cependant, les incertitudes scientifiques entourant les TEMP entraînent souvent des retards dans l’approbation du marché.
Le choix des sources cellulaires pose également des problèmes éthiques, les cellules souches provenant de donneurs adultes étant couramment utilisées malgré les risques potentiels de sécurité à long terme et les problèmes d’immunogénicité. La variabilité après l’implantation des TEMP est un autre problème, car les cellules métaboliquement actives dans l’environnement de l’hôte peuvent provoquer des réactions immunitaires ou des incompatibilités.
Questions éthiques relatives à l’utilisation des cellules et aux cellules souches pluripotentes induites (CSPi)
En outre, les cellules souches embryonnaires humaines (CSE) sont depuis longtemps au centre des controverses éthiques dans le domaine de la bio-impression en raison de leur dérivation d’embryons humains. Bien qu’elles possèdent un énorme potentiel de différenciation en n’importe quel type de cellule du corps humain, leur utilisation soulève de profondes questions éthiques concernant le début de la vie humaine et le statut moral des embryons. L’obtention de CSE humains à des fins de recherche implique la destruction d’embryons humains, ce qui suscite de vifs débats sur le début de la vie et les implications morales de la destruction d’embryons. De plus, la commercialisation des produits dérivés des CSE humains s’est heurtée à la résistance des groupes religieux et des organisations éthiques. Les considérations religieuses soulignent l’importance d’engager des discussions éthiques transparentes et de prendre en compte diverses perspectives lors de l’élaboration de lignes directrices et de réglementations pour la bio-impression impliquant des CSE humains.
Cellules souches embryonnaires (crédits photo : BioTechne)
L’utilisation de cellules souches pluripotentes induites (CSPI) constitue un autre défi éthique. Leur utilisation en bio-impression 3D est extrêmement prometteuse pour la médecine régénérative. Les CSPi sont des cellules adultes qui ont été génétiquement reprogrammées pour posséder des propriétés semblables à celles des cellules souches embryonnaires, ce qui les rend capables de se différencier en divers types de cellules. Cette capacité à générer des cellules spécifiques au patient sans les problèmes éthiques associés aux cellules souches embryonnaires humaines a fait des CSPi une option attrayante dans le domaine de la bio-impression. Cependant, leur utilisation n’est pas sans poser des problèmes éthiques. L’une des préoccupations majeures est le risque de reprogrammation anormale au cours du processus d’induction des CSPi. Des études, telles que celle menée par Keisuke Okita, maître de conférences au Centre de recherche et d’application des cellules CSPi de l’université de Kyoto, au Japon, ont mis en évidence la nécessité de faire preuve de prudence pour éviter les aberrations génétiques et garantir la sécurité des tissus ou des organes bio-imprimés.
En outre, la tumorigénicité, c’est-à-dire la production ou la tendance à produire des tumeurs, a été observée dans les CSPi au cours de la thérapie par cellules souches. Une étude menée par Andrew S. Lee, chercheur à l’Institute for Stem Cell Biology and Regenerative Medicine, Stanford University School of Medicine, souligne l’importance d’aborder ce risque afin d’éviter la formation de tumeurs chez les patients recevant des traitements à base de CSPi. « Les cellules souches pluripotentes (CSP), y compris les cellules souches embryonnaires (CSE) et les cellules souches pluripotentes induites (CSPi), offrent un immense potentiel en tant que source de thérapies régénératives. Cependant, les qualités intrinsèques d’autorenouvellement et de pluripotence qui rendent ces cellules si prometteuses sur le plan thérapeutique sont également responsables d’un potentiel tumorigène tout aussi fondamental« .
L’étude poursuit en mentionnant que « les risques de tumorigénicité des CSP ont été mis en évidence au cours des dernières années dans un certain nombre d’études sur des animaux de petite et de grande taille« . Garantir la sécurité et l’efficacité des produits dérivés des CSPi est essentiel pour maintenir la confiance du public dans la technologie et protéger le bien-être des patients, et reste un obstacle pour les thérapies à base de cellules souches pluripotentes.
Vue microscopique des cellules souches pluripotentes induites (crédits photo : Gladstone Institute)
Propriété
Propriété des produits bio-imprimés
Étant donné que la bio-impression implique l’utilisation de cellules souches humaines et de leurs composants génétiques, la question de savoir qui possède les droits de propriété sur les produits bio-imprimés qui en résultent devrait alimenter d’intenses discussions. Ce débat s’étend au domaine des données relatives aux patients et, dans ce contexte, au matériel génétique des patients eux-mêmes. Les parties intéressées sont les prestataires de soins de santé, les chercheurs, les entreprises de biotechnologie et, surtout, les patients. Pour prévenir l’émergence potentielle d’un marché illicite des organes issus de la bio-ingénierie, il est probable que des experts juridiques et médicaux devront collaborer afin d’établir des lignes directrices éthiques claires pour la gestion de ces actifs. Cette collaboration vise à garantir l’équité tant pour les patients que pour les autres parties prenantes.
Propriété intellectuelle
Niki Vermeulen, chercheur au Centre for Science and Technology Studies (CWTS), explore en profondeur les complexités liées à la formulation d’un cadre de propriété intellectuelle pour le domaine de la bio-impression. Dans une étude sur la vision socio-éthique de l’impression d’organes humains, Niki affirme que ces « nouvelles formes d’impression auront le même effet révolutionnaire et démocratisant que l’impression de livres dans leur applicabilité à la médecine régénérative et à l’industrie« , prédisant que les structures biologiques conçues pour les individus deviendront « aussi disponibles que les textes dans les sociétés modernes alphabétisées« . Elle poursuit en décrivant les similitudes de processus, de développement et d’accessibilité entre la bio-impression 3D du 21e siècle et la presse à imprimer du 15e siècle, en établissant plusieurs parallèles.
L’étude pose un dilemme important, à savoir si la bio-impression doit être classée comme un dispositif médical susceptible d’être protégé par un brevet ou comme une procédure médicale non brevetable. La question est de savoir si la technologie doit être considérée uniquement comme une innovation commercialement viable ou comme une pratique médicale fondamentale pour l’avenir, voire comme les deux à la fois. En outre, un débat en cours porte sur la question de savoir si l’octroi de brevets favorise ou entrave l’innovation. Il est important de noter que, dans ce contexte, le résultat peut avoir un impact direct sur la vie de millions de personnes. Niki Vermeulen et ses collègues suggèrent qu’une solution plausible à cette situation difficile implique l’engagement collaboratif des secteurs privé et public. Cet effort collectif vise à établir des mécanismes de création et de distribution équitable des bénéfices de la recherche.

La question de la propriété en bio-impression est une préoccupation majeure (crédits photo : American College of Cardiology Foundation (à gauche) et Pixstastock (à droite))
Essais cliniques
Conception d’essais cliniques éthiques
La conception d’essais cliniques éthiques pour la bio-impression 3D devient essentielle pour garantir des traitements personnalisés et efficaces. Les critères d’inclusion et la participation de patients en phase terminale nécessitent une évaluation éthique minutieuse afin d’équilibrer les risques et les avantages potentiels et de respecter les principes éthiques dans la recherche et la pratique clinique. Les dimensions éthiques et juridiques de la bio-impression 3D sont de la plus haute importance pour le développement et l’application responsables de cette technologie transformatrice. Alors que nous explorons le vaste potentiel de la bio-impression pour révolutionner les soins de santé, il est impératif d’engager des discussions continues, de mettre en œuvre des réglementations solides et d’établir des lignes directrices éthiques claires pour garantir son intégration éthique et bénéfique dans les pratiques de soins de santé courantes. En relevant ces défis éthiques de manière proactive, nous pouvons ouvrir la voie à l’avancement éthique de la bio-impression, au bénéfice des patients et de la société dans son ensemble.
Pour ce qui est de l’avenir, la bio-impression 3D est prometteuse, avec la commercialisation potentielle de modèles de tissus bio-imprimés et d’organes sur puce dans les 5 à 8 prochaines années. Toutefois, la commercialisation de tissus et d’organes imprimés en 3D pourrait prendre des décennies en raison de leur nature complexe et de leur composition biologique. Il sera essentiel de relever des défis tels que l’impression à haute résolution, la culture de tissus hétérogènes, le développement de réseaux vasculaires et la résolution des problèmes d’éthique et de sécurité pour réaliser le plein potentiel de la bio-impression 3D dans les applications cliniques.
Les pratiques actuelles sont-elles à la hauteur ?
Mais la vraie question est de savoir si les normes actuelles en matière de bio-impression remplissent leur rôle. Il semble que les pratiques actuelles en matière de bio-impression progressent, mais qu’elles se heurtent à des problèmes de normalisation et de fiabilité. Malgré les avancées significatives de la technologie de la bio-impression, il arrive que les pratiques ne répondent pas aux normes souhaitées.
L’absence de biomatériaux normalisés adaptés aux processus de bio-impression constitue un obstacle majeur. Les variations des propriétés des matériaux peuvent entraîner des incohérences dans les propriétés mécaniques, les taux de dégradation et la biocompatibilité des structures imprimées, ce qui affecte la fonctionnalité et la sécurité globales. Un autre problème concerne la viabilité et la fonctionnalité de ces structures. Alors que les chercheurs s’efforcent d’assurer la viabilité des cellules, il arrive que le processus d’impression compromette la survie et le comportement des cellules intégrées, notamment sous l’effet des forces mécaniques.
En outre, l’absence de protocoles normalisés pour la caractérisation et l’évaluation des structures bio-imprimées entrave le contrôle de la qualité. Les variations des critères d’évaluation rendent difficile la comparaison des résultats entre les études. Un autre défi important concerne l’intégration de réseaux vasculaires fonctionnels dans les tissus bio-imprimés pour un approvisionnement adéquat en nutriments. Les efforts pour créer des vaisseaux sanguins fonctionnels se sont heurtés à la complexité, ce qui a eu un impact sur la vascularisation de tissus plus larges, et les techniques doivent être améliorées. De plus, divers scénarios, tels que la production d’organes humains, soulèvent des questions concernant la propriété des organes, le consentement des patients et les voies réglementaires. Il est donc de plus en plus nécessaire de disposer de cadres éthiques et réglementaires complets spécifiques à la bio-impression.
En résumé, bien que la bio-impression ait progressé, les défis liés aux biomatériaux, à la viabilité des cellules et à la caractérisation montrent que les pratiques actuelles ne sont pas à la hauteur. Ces défis soulignent l’importance des efforts continus pour normaliser les lignes directrices et les protocoles afin d’améliorer la fiabilité et la cohérence de la bio-impression. Ces exemples montrent bien la complexité de la bio-impression et la nécessité de relever les défis techniques, éthiques et réglementaires pour obtenir des normes universellement acceptées.
Pensez-vous que les normes actuelles sont suffisantes face à ces considérations éthiques ? Partagez votre avis dans les commentaires de l’article. Retrouvez toutes nos vidéos sur notre chaîne YouTube ou suivez-nous sur Facebook ou Twitter !
*Crédits photo de couverture : Deep-image.ai






