Un nuovo studio esamina i principali ostacoli legali per la stampa 3D medicale nell’UE

Negli ultimi anni il mercato della stampa 3D medicale ha registrato una forte crescita. Nell’Unione Europea si prevede che il mercato complessivo dell’Additive Manufacturing per la sanità crescerà a un tasso CAGR del 15,4% fino al 2029. Non sorprende se si considera che l’anno scorso l‘Ufficio europeo dei brevetti ha rilevato che le famiglie di brevetti internazionali relativi alle tecnologie di stampa 3D sono cresciute a un tasso annuo del 26,4% nella regione, di cui quasi un quinto tra il 2001 e il 2020 nel settore sanitario. Ma ci sono fattori che stanno ancora rallentando la sua crescita?
Una nuova ricerca del Dr. Marc Mimler, docente senior di diritto presso la City Law School, sembra suggerire di sì. Nell’articolo “Core Legal Challenges for Medical 3D Printing in the EU”, Mimler, insieme ad altri collaboratori di diversi ospedali universitari e dipartimenti di ingegneria meccanica, ha cercato di esaminare la legislazione e la giurisprudenza dell’UE, circa il Regolamento sui dispositivi medici (Medical Device Regulation – MDR), su questioni relative all’approvazione prima dell’immissione sul mercato e alla responsabilità post-vendita dei dispositivi stampati in 3D. I risultati sembrano mostrare che le aree grigie all’interno di questa normativa stanno effettivamente ostacolando la crescita della stampa 3D in campo medicale e che è necessario lavorare ancora per chiarire la questione.
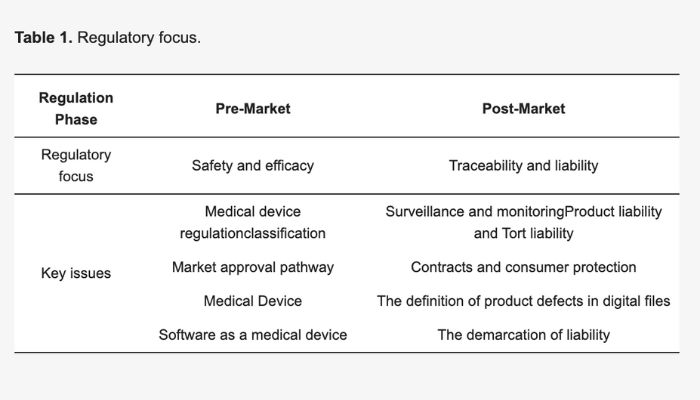
Lo studio si concentra sulle normative pre-market e post-market per i dispositivi medici stampati in 3D (crediti immagine: Mimler et al.)
Le leggi UE ostacolano la crescita della stampa 3D medicale?
I risultati, illustrati in un comunicato stampa della City School, sono suddivisi in base allo stato pre-market e post-market. Esaminando le leggi pre-market, i ricercatori si sono concentrati sulla normativa “Custom Device Exemption” dell’UE, che consente ai dispositivi realizzati in base a una descrizione scritta da una persona autorizzata di aggirare i requisiti come la marcatura CE. Sebbene ciò sembri positivo per la stampa 3D, il fatto che i dispositivi ‘patient-matched’ (realizzati su misura) non rientrino in questa esenzione crea una zona grigia per i dispositivi medici stampati in 3D. Soprattutto perché questa distinzione non esiste per i dispositivi ‘personalizzati in massa’.
Di conseguenza, la conformità normativa è incerta per i dispositivi realizzati con la produzione additiva. Questa confusione è ulteriormente aggravata dal fatto che, mentre la produzione di dispositivi stampati in 3D all’interno di istituzioni sanitarie e ospedali può rientrare nell’Health Institution Exemption del Regolamento relativo ai dispostivi medici, ciò non si applica ad altre aziende. Per le istituzioni e le aziende più piccole è quindi difficile orientarsi nel panorama normativo dei dispositivi stampati in 3D su misura.
Ciò riguarda l’approvazione pre-market dei dispositivi, ma anche i regolamenti post-market sembrano essere poco chiari per la stampa 3D in campo sanitario. A causa dell’approccio più rigoroso dell’UE alla sorveglianza e al monitoraggio dei dispositivi medici dopo l’immissione sul mercato, la responsabilità del prodotto per i dispositivi stampati in 3D non è chiara ai sensi del MDR.
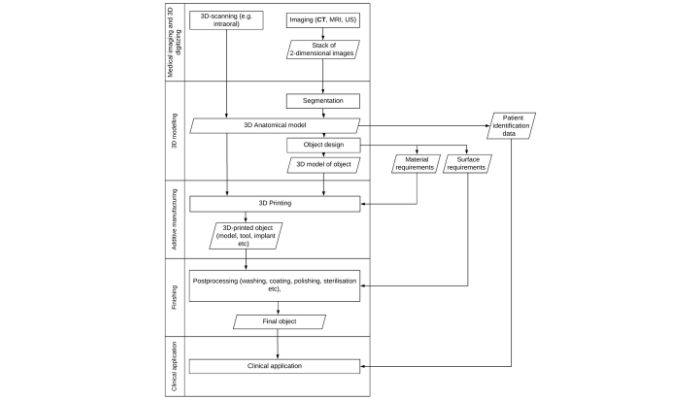
La natura decentralizzata del processo per i dispositivi medici stampati in 3D (come mostrato sopra) può causare confusione e problemi per le normative post-market (crediti immagine: Mimler et al.)
Questo, sostengono gli autori, soffoca l’innovazione nel settore, poiché soggetti come chirurghi, produttori terzi e produttori interni potrebbero essere ritenuti responsabili di eventuali difetti dopo l’impianto di un dispositivo stampato in 3D in un paziente. La confusione è il risultato diretto del fatto che non è chiaro chi sia esattamente il produttore a causa della natura decentralizzata della stampa 3D. L’incertezza sulle leggi in materia di protezione dei dati e di proprietà intellettuale non fa che complicare ulteriormente la situazione.
Nel complesso, i ricercatori ritengono che sia importante riesaminare quelli che considerano requisiti conservativi e ambigui nell’ambito del MDR in termini di dispositivi stampati in 3D. Essi sostengono che attualmente il sistema ostacola l’innovazione nel settore e ritarda l’assistenza ai nuovi pazienti, in quanto gli attori potrebbero non essere in grado di orientarsi nell’attuale scenario normativo per i dispositivi su misura. Per saperne di più, è possibile consultare lo studio completo QUI.
Cosa ne pensi di questa notizia? Faccelo sapere lasciando un commento sui nostri social Facebook e LinkedIn. Trovi tutti i nostri video sul nostro canale YouTube! Non dimenticare di iscriverti alla nostra Newsletter settimanale per ricevere tutte le notizie sulla stampa 3D direttamente nella casella di posta!





