Bioprinting unter die Lupe genommen: Sind die derzeitigen Standards ethisch vertretbar?

In der sich rasch entwickelnden Landschaft der Biotechnologie hat sich das dreidimensionale (3D) Bioprinting (Biodruck) als Hoffnungsträger für die Umgestaltung des Gesundheitswesens und die Bewältigung kritischer medizinischer Herausforderungen erwiesen, darunter Organtransplantationen, Gewebezüchtung, Arzneimittelprüfung und -entwicklung, personalisierte Medizin, Nervenregeneration, Krankheitsmodellierung und vieles mehr. Mit dem Potential, die Art und Weise, wie wir die moderne Medizin konfrontieren, zu revolutionieren, gewinnt das Bioprinting zunehmend an Aufmerksamkeit bei Forschern, Investoren und Fachleuten im Gesundheitswesen gleichermaßen. Mit der rasanten Entwicklung der Bioprinting-Technologie müssen jedoch auch ethische Überlegungen, rechtliche Rahmenbedingungen und regulatorische Herausforderungen kritisch geprüft werden.
Angesichts des anhaltenden Wachstums, das erhebliche Investitionen anzieht, wird es immer dringlicher, sich mit den komplexen ethischen Fragen im Zusammenhang mit dem 3D-Biodruck auseinanderzusetzen. Um dies besser zu verstehen, haben wir einen prüfenden Blick auf die Bioprinting-Industrie geworfen und die ethischen Bedenken untersucht, die sich aus der Herstellung künstlicher, menschlicher Organe ergeben. Dabei gehen wir auch auf die umstrittene Verwendung menschlicher embryonaler Stammzellen und die potentiellen Risiken im Zusammenhang mit induzierten pluripotenten Stammzellen ein und auch auf Digitalisierung, klinische Versuche und Tierversuche, um nur einige zu nennen.
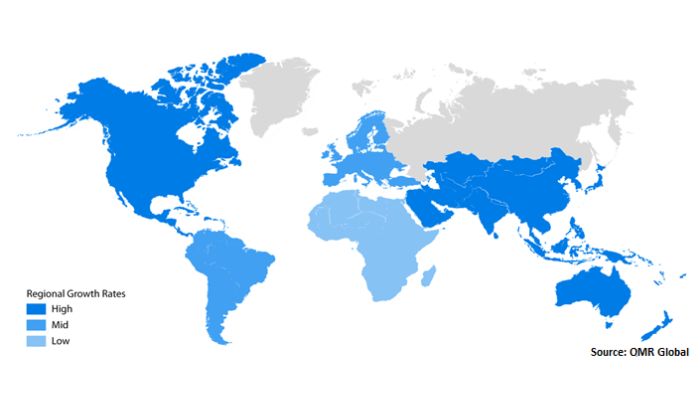
Der weltweite Markt für 3D-Bioprinting wird 2022 auf 2,13 Milliarden geschätzt und soll bis 2030 rund 8,3 Milliarden erreichen (Bild: OMR Global).
Wir nehmen das Bioprinting unter die Lupe und untersuchen das komplizierte Zusammenspiel zwischen seinem außerordentlichen Potential und der dringenden Notwendigkeit einer verantwortungsvollen Verwaltung. Bei der Navigation durch diese komplexen Zusammenhänge ist es wichtig, das heikle Gleichgewicht zwischen Innovation und ethischer Verantwortung zu finden, um sicherzustellen, dass die Zukunft der Medizin mit gutem Gewissen voranschreitet.
Universelle Gesetze und Normen in der Biomedizin
Um mögliche Verbesserungen zu verstehen, muss man sich mit den bestehenden Gesetzen und Normen auseinandersetzen. Im Bereich der Biomedizin bilden diese Vorschriften einen umfassenden Rahmen, der die medizinischen und biologischen Aspekte, die Forschungsbemühungen und die technologischen Innovationen überwacht. Diese Gesetze und Normen spielen eine zentrale Rolle bei der Gewährleistung der Patientensicherheit, der Berücksichtigung ethischer Erwägungen, der Wahrung der Integrität der Forschung und der Förderung eines verantwortungsvollen, medizinischen Fortschritts. Dieser Rahmen dient als Richtlinie für verschiedene Bereiche, die jeweils einen eigenen Schwerpunkt haben.
Die Bereiche Klinische Versuche und Forschungsethik sind beispielsweise von grundlegender Bedeutung, da sie den Umgang mit menschlichen Probanden in der Forschung und in klinischen Versuchen beaufsichtigen. Gremien wie Institutional Review Boards (IRBs) sorgen für die Einwilligung nach Aufklärung, den Schutz der Teilnehmerrechte und die Einhaltung ethischer Grundsätze. Gleichzeitig tragen staatliche Aufsichtsbehörden wie die FDA die Verantwortung für die Überwachung der gesamten Entwicklung von Medizinprodukten. Auch Datenschutzgesetze wie GDPR und HIPAA dürfen nicht vergessen werden, da sie als Mittel zum Schutz der Speicherung und Verwendung sensibler, medizinischer Daten immer wichtiger werden. In ähnlicher Weise muss auch das geistige Eigentum berücksichtigt werden, wenn es um Innovationen in diesem Bereich geht.
Besonders wichtig im Bereich des Bioprinting ist die Stammzellenforschung, die einen einzigartigen Platz an der Schnittstelle zwischen wissenschaftlichem Fortschritt und ethischen Erwägungen einnimmt und zulässige Grenzen aufzeigt, die den komplexen Bereich der embryonalen Stammzellen einschließen. Bei der Organtransplantation geht es um die Balance zwischen dem Wohlergehen der Patienten und der ethisch vertretbaren Beschaffung von Organen, wobei ein Gleichgewicht auf der Grundlage von Fairness und Verantwortung angestrebt wird. Darüber hinaus gibt es noch viele weitere Aspekte der Gesundheitsversorgung, einschließlich der Reproduktion, die in dieser Hinsicht beleuchtet werden müssen.
Zusammengefasst schaffen diese rechtlichen Dimensionen eine Landschaft, in der sich der biomedizinische Fortschritt entfalten kann. Gesetze und Normen in der Biomedizin, die sich über verschiedene Regionen hinweg anpassen und weiterentwickeln, müssen auf die sich ständig verändernde Landschaft des wissenschaftlichen Fortschritts und der gesellschaftlichen Belange abgestimmt sein. Dieses dynamische Gleichgewicht stellt sicher, dass der medizinische Fortschritt innerhalb der Grenzen eines verantwortungsvollen und ethischen Verhaltens erfolgt. Auf diese Weise ist das Bioprinting nicht vollständig abgedeckt, sondern kann im Rahmen der Gesetzgebung verschiedener Gremien betrieben werden.

Derzeit gibt es zwar keine umfassenden Vorschriften für den gesamten Bioprinting-Prozess, aber es gibt eine Teilgesetzgebung für Tissue Engineering und regenerative Medizin (Bild: Walden University)
Gesetze und Normen für Bioprinting
Um dies besser zu verstehen, muss nun untersucht werden, wie die Gesetze direkt auf den sich ständig weiterentwickelnden Bereich des Bioprinting angewendet werden. Der Abschnitt „Universal standards for tissue engineered products“ in der Studie „Current standards and ethical landscape of engineered tissues-3D bioprinting perspective“, die von PubMed Central veröffentlicht wurde, erörtert die Bedeutung universeller Normen für medizinische Gewebeprodukte (tissue engineered medical products, TEMPs), um weltweit eine einheitliche Qualität zu gewährleisten. Diese Standards werden von Organisationen wie der International Organization of Standards (ISO) und der American Society for Testing and Materials (ASTM) international festgelegt.
Sowohl die ASTM als auch die ISO haben eine Liste von Normen für TEMPs veröffentlicht, die verschiedene Aspekte wie Klassifizierung, Biomaterialien, Zell- und Gewebekonstrukte, Sicherheit und Bewertungen abdecken. Diese Normen tragen dazu bei, die Sicherheit und Qualität von Produkten aus Gewebezüchtungen von der vorklinischen Forschung bis zu klinischen Versuchen zu regeln und zu gewährleisten. Darüber hinaus hat die ISO mit verschiedenen Organisationen und Experten zusammengearbeitet, um die weltweiten Standards und die Qualität kontinuierlich zu verbessern, insbesondere für additive Fertigungsverfahren, die in verschiedenen Bereichen, einschließlich der Medizin, eingesetzt werden.
Insgesamt spielen diese universellen Normen eine entscheidende Rolle bei der Validierung medizinischer Produkte, einschließlich der Produkte aus Gewebezüchtungen, und bei der Gewährleistung ihrer Sicherheit und Wirksamkeit für den menschlichen Gebrauch. Da es sich bei der Bioprinting-Technologie um einen sich schnell entwickelnden Bereich handelt, entwickeln sich die Normen und Organisationen, die an der Festlegung solcher Normen beteiligt sind, ebenfalls ständig weiter. Während spezifische Normen variieren können, gibt es allgemeine Trends und Aspekte im Zusammenhang mit Normen für das Bioprinting, die folgende Punkte betreffen:
- Materialstandards: Es besteht ein Bedarf an standardisierten Biomaterialien, die mit Bioprinting-Verfahren kompatibel und für die Verwendung mit lebenden Zellen sicher sind. Die verwendeten Materialien sollten geeignete mechanische Eigenschaften, Biokompatibilität und Abbaugeschwindigkeiten aufweisen. Es werden ständig Anstrengungen unternommen, um Standards für die Qualität und die Eigenschaften von Biotinten und Gerüstmaterialien festzulegen.
- Lebensfähigkeit und Funktionsfähigkeit von Zellen: Es werden Normen entwickelt, die sicherstellen sollen, dass die Lebensfähigkeit und Funktionalität der Zellen bei biologisch gedruckten Konstrukten erhalten bleibt. Bioprinting-Prozesse sollten die Lebensfähigkeit und das Verhalten der eingebetteten Zellen nicht beeinträchtigen, damit sie wachsen, sich differenzieren und ihre vorgesehenen Funktionen erfüllen können.
- Druckbarkeit und Auflösung: Richtlinien für das Design und den Druck komplexer Strukturen werden erforscht. Druckbarkeitsfaktoren wie Auflösung, Schichtdicke und Düsendurchmesser müssen standardisiert werden, um die Genauigkeit und Reproduzierbarkeit von biologisch gedruckten Konstrukten zu gewährleisten.
- Bioreaktorkultur: Biodruck-Konstrukte müssen nach dem Druck häufig in Bioreaktoren kultiviert werden. Für die Kulturbedingungen, einschließlich Temperatur, Luftfeuchtigkeit, Nährstoffzufuhr und mechanischer Stimulation, werden Standards geprüft, um ein optimales Zellwachstum und eine optimale Gewebeentwicklung zu fördern.
- Qualitätskontrolle und Charakterisierung: Standardisierte Methoden zur Qualitätskontrolle und Charakterisierung von biologisch gedruckten Konstrukten sind unerlässlich. Dazu gehören die Bewertung der Zelllebensfähigkeit, der Zellverteilung, der Gewebemorphologie, der mechanischen Eigenschaften und der Funktionalität.
- Ethische und regulatorische Erwägungen: Beim Bioprinting wird mit lebenden Zellen und Geweben gearbeitet, was ethische und rechtliche Überlegungen aufwirft. Es wird nach Standards gesucht, die eine verantwortungsvolle und sichere Nutzung von Bioprinting-Technologien gewährleisten und Fragen der Patientensicherheit, der Einwilligung und des geistigen Eigentums behandeln.
- Kalibrierung und Validierung von Biodruckern: Um die Genauigkeit und Reproduzierbarkeit von Bioprinting-Prozessen zu gewährleisten, sind standardisierte Kalibrierungs- und Validierungsprotokolle für Biodrucker erforderlich. Dies trägt zur Erzielung einheitlicher Ergebnisse in verschiedenen Labors und Systemen bei.
- Berichterstattung und gemeinsame Nutzung von Daten: Eine standardisierte Berichterstattung über Bioprinting-Prozesse, -Materialien und -Ergebnisse ist von entscheidender Bedeutung, um die Zusammenarbeit, die Reproduzierbarkeit und den Vergleich von Forschungsergebnissen zu erleichtern. Die offene Weitergabe von Daten und Methoden kann den Fortschritt in diesem Bereich beschleunigen.
Aufschlüsselung der Regeln und Richtlinien
Gegenwärtig gibt es erhebliche Herausforderungen bei der klinischen Umsetzung von künstlich hergestellten und gedruckten Geweben (TEMPs – transformation of engineered and bioprinted tissues). Ein Hauptproblem ist das Fehlen weltweit standardisierter regulatorischer Überlegungen für solche Gewebe, was Änderungen der aktuellen Normen und Vorschriften erforderlich macht. Die regulatorischen Richtlinien unterscheiden sich von Region zu Region, was eine einheitliche klinische Umsetzung dieser Fragen erschwert. Um diese Herausforderungen zu bewältigen, verfolgen viele Aufsichtsbehörden bei der Zulassung von gedruckten Bio-Geweben einen adaptiven Ansatz, der ihre Komplexität und Unzuverlässigkeit aufgrund der Verwendung von natürlichen Biomaterialien und Zellen berücksichtigt. Die wissenschaftlichen Unwägbarkeiten im Zusammenhang mit TEMP führen jedoch häufig zu Verzögerungen bei der Marktzulassung.
Ethische Bedenken ergeben sich auch hinsichtlich der Wahl der Zellquellen, wobei trotz potentieller langfristiger Sicherheitsrisiken und Immunogenitätsprobleme häufig Stammzellen von erwachsenen Spendern verwendet werden. Ein weiteres Problem ist die Variabilität nach der Implantation von TEMPs, da metabolisch aktive Zellen in der Wirtsumgebung Immunreaktionen oder Fehlanpassungen verursachen können.
Ethische Fragen im Zusammenhang mit der Verwendung von Stammzellen
Darüber hinaus stehen menschliche embryonale Stammzellen (embryonic stem cells – ESC) seit langem im Mittelpunkt ethischer Kontroversen beim Bioprinting, da sie aus menschlichen Embryonen gewonnen werden. Sie besitzen zwar ein enormes Potential, sich in jeden Zelltyp des menschlichen Körpers zu differenzieren, ihre Verwendung wirft jedoch tiefgreifende ethische Fragen hinsichtlich des Beginns des menschlichen Lebens und des moralischen Status von Embryonen auf. Die Gewinnung menschlicher Embryo-Stammzellen zu Forschungszwecken ist mit der Zerstörung menschlicher Embryonen verbunden, was zu hitzigen Debatten darüber führt, wann das Leben beginnt und welche moralischen Auswirkungen die Zerstörung von Embryonen hat. Darüber hinaus stößt die Kommerzialisierung von aus menschlichen embryonalen Stammzellen gewonnenen Produkten bei religiösen Gruppen und ethischen Organisationen auf Widerstand. Religiöse Erwägungen unterstreichen, wie wichtig es ist, transparente ethische Diskussionen zu führen und verschiedene Perspektiven zu berücksichtigen, wenn Richtlinien und Vorschriften für das Bioprinting mit menschlichen embryonalen Stammzellen entwickelt werden.
Embryonale Stammzellen (Bild: BioTechne)
Eine weitere ethische Herausforderung ergibt sich aus der Verwendung von induzierten pluripotenten Stammzellen (induced pluripotent stem cells – iPSCs). Die Verwendung induzierter pluripotenter Stammzellen (iPSC) beim 3D-Bioprinting ist ein vielversprechender Ansatz für die regenerative Medizin. iPSC sind erwachsene, reife Zellen, die genetisch so umprogrammiert wurden, dass sie embryonale stammzellähnliche Eigenschaften besitzen und sich in verschiedene Zelltypen differenzieren können. Diese Fähigkeit, patientenspezifische Zellen zu erzeugen, ohne die ethischen Bedenken, die mit menschlichen embryonalen Stammzellen verbunden sind, hat iPSCs zu einer attraktiven Option im Bereich des Bioprinting gemacht. Die Verwendung von iPSCs ist jedoch nicht ohne ethische Probleme. Eine große Sorge ist die Möglichkeit einer abnormen Reprogrammierung während des iPSC-Induktionsprozesses. Studien wie die von Keisuke Okita, Dozent am Zentrum für iPS-Zellforschung und -anwendung an der Universität Kyoto, Japan, haben gezeigt, dass Vorsicht geboten ist, um genetische Fehlentwicklungen zu vermeiden und die Sicherheit von biologisch gedruckten Geweben oder Organen zu gewährleisten.
Darüber hinaus wurde bei iPSCs während der Stammzelltherapie Tumorigenität, d. h. die Bildung von oder die Neigung zur Bildung von Tumoren, beobachtet. Eine Studie von Andrew S. Lee, Forscher am Institute for Stem Cell Biology and Regenerative Medicine der Stanford University School of Medicine, unterstreicht, wie wichtig es ist, dieses Risiko anzugehen, um die Bildung von Tumoren bei Patienten zu vermeiden, die mit iPSC behandelt werden. „Pluripotente Stammzellen (PSCs), einschließlich embryonaler (ESCs) und induzierter pluripotenter Stammzellen (iPSCs), bieten ein immenses Potential als Quelle für regenerative Therapien. Die diesen Zellen innewohnenden Eigenschaften der Selbsterneuerung und Pluripotenz, die sie therapeutisch so vielversprechend machen, sind jedoch auch für ein ebenso grundlegendes tumorigenes Potential verantwortlich.“
In der Studie heißt es weiter: „Die Risiken der Tumorigenität von PSC wurden in den letzten Jahren in einer Reihe von kleinen und großen Tierstudien hervorgehoben.“ Die Gewährleistung der Sicherheit und Wirksamkeit von aus iPSC abgeleiteten Produkten ist von entscheidender Bedeutung, um das Vertrauen der Öffentlichkeit in diese Technologie zu erhalten und das Wohl der Patienten zu schützen und bleibt eine Hürde für pluripotente Stammzelltherapien.
Mikroskopische Ansicht von induzierten pluripotenten Stammzellen (Bild: Gladstone Institute)
Eigentümerschaft
Eigentumsrechte an Bioprinting-Produkten
Da beim Bioprinting menschliche Stammzellen und deren genetische Bestandteile verwendet werden, ist zu erwarten, dass die Frage, wer die Eigentumsrechte an den daraus entstehenden Bioprinting-Produkten besitzt, zu intensiven Diskussionen führen wird. Diese Debatte erstreckt sich auch auf den Bereich der Patientendaten und in diesem Zusammenhang auf das genetische Material der Patienten selbst. Zu den Interessensgruppen gehören Gesundheitsdienstleister, Forscher, Biotechnologieunternehmen und vor allem die Patienten. Um das mögliche Entstehen eines illegalen Marktes für biotechnologisch hergestellte Organe zu verhindern, ist es wahrscheinlich, dass Rechts- und Medizinexperten zusammenarbeiten müssen, um klare ethische Richtlinien für den Umgang mit diesen Gütern festzulegen. Diese Zusammenarbeit soll sicherstellen, dass sowohl den Patienten als auch den anderen Beteiligten Gerechtigkeit zukommt.
Eigentum an geistigem Eigentum
Niki Vermeulen, Forscherin am Zentrum für Wissenschafts- und Technologiestudien (CWTS), untersucht ausführlich die Komplexität, die mit der Formulierung eines Rahmens für das geistige Eigentum auf dem Gebiet des Bioprinting verbunden ist. In einer Studie über die sozioethische Sicht des Druckens menschlicher Organe behauptet Vermeulen, dass diese „neuen Formen des Druckens in ihrer Anwendbarkeit für die regenerative Medizin und die Industrie die gleiche revolutionäre und demokratisierende Wirkung haben werden wie der Buchdruck“ und prognostiziert, dass biologische Strukturen, die für Einzelpersonen entworfen wurden, „so verfügbar werden wie Texte in modernen, gebildeten Gesellschaften.“ Sie beschreibt die Ähnlichkeiten zwischen dem 3D-Biodruck des 21. Jahrhunderts und dem Buchdruck des 15. Jahrhunderts in Bezug auf Verfahren, Entwicklung und Zugänglichkeit und zieht mehrere Parallelen.
Die Studie wirft die Frage auf, ob das Bioprinting als patentierbares Medizinprodukt oder als nicht patentierbares medizinisches Verfahren eingestuft werden soll. Dabei geht es um die Frage, ob die Technologie ausschließlich als kommerziell nutzbare Innovation oder als grundlegende medizinische Praxis der Zukunft zu betrachten ist, die möglicherweise beide Aspekte in sich vereint. Darüber hinaus wird immer wieder diskutiert, ob die Erteilung von Patenten die Innovation fördert oder behindert. Wichtig ist in diesem Zusammenhang, dass das Ergebnis einen direkten Einfluss auf das Leben von Millionen von Menschen haben kann. Vermeulen und ihre Kollegen schlagen vor, dass eine plausible Lösung für dieses Dilemma das gemeinsame Engagement des privaten und des öffentlichen Sektors beinhaltet. Diese kollektive Anstrengung zielt darauf ab, Mechanismen für die Schaffung und gerechte Verteilung von Forschungsergebnissen zu schaffen.

Ownership over one’s bio-printed and intellectual property is a future concern (photo credits: American College of Cardiology Foundation (left) and Pixstastock (right))
Klinische Studien
Ethische Gestaltung klinischer Studien
Die Planung ethischer klinischer Studien für 3D-Bioprinting ist unerlässlich, um personalisierte und wirksame Behandlungen zu gewährleisten. Die Einschlusskriterien und die Teilnahme todkranker Patienten erfordern eine sorgfältige ethische Bewertung, um potentielle Risiken und Vorteile abzuwägen und ethische Grundsätze in Forschung und klinischer Praxis zu wahren. Die ethischen und rechtlichen Aspekte des 3D-Bioprinting sind von größter Bedeutung für die verantwortungsvolle Entwicklung und Anwendung dieser transformativen Technologie. Bei der Erforschung des enormen Potentials des Bioprinting für die Revolutionierung des Gesundheitswesens ist es unerlässlich, sich an laufenden Diskussionen zu beteiligen, solide Vorschriften einzuführen und klare ethische Richtlinien festzulegen, um die ethische und nutzbringende Integration dieser Technologie in die allgemeine Gesundheitspraxis zu gewährleisten. Wenn wir diese ethischen Herausforderungen proaktiv angehen, können wir den Weg für eine ethische Weiterentwicklung des Bioprinting ebnen, von der Patienten und die gesamte Gesellschaft profitieren.
Mit Blick auf die Zukunft ist das 3D-Biodrucken vielversprechend, da biologisch gedruckte Gewebemodelle und Organ-on-Chip in den nächsten fünf bis acht Jahren auf den Markt kommen könnten. Die Kommerzialisierung von 3D-gedruckten Geweben und Organen kann jedoch aufgrund ihrer komplexen Natur und biologischen Zusammensetzung Jahrzehnte dauern. Die Bewältigung von Herausforderungen wie dem hochauflösenden Druck, der Kultivierung heterogener Gewebe, der Entwicklung vaskulärer Netzwerke und der Berücksichtigung ethischer und sicherheitstechnischer Bedenken wird entscheidend sein, um das volle Potential des 3D-Biodrucks in klinischen Anwendungen auszuschöpfen.
Entsprechen die derzeitigen Praktiken dem Standard?
Die eigentliche Frage ist jedoch, ob die derzeitigen Bioprinting-Normen ihre Aufgabe erfüllen. Es hat den Anschein, dass die derzeitigen Praktiken im Bioprinting zwar Fortschritte machen, aber mit Herausforderungen bei der Standardisierung und Zuverlässigkeit zu kämpfen haben. Trotz erheblicher Fortschritte in der Bioprinting-Technologie gibt es Fälle, in denen die Verfahren nicht den gewünschten Standards entsprechen.
Ein wesentliches Hindernis ist der Mangel an standardisierten Biomaterialien, die für Bioprinting-Verfahren geeignet sind. Unterschiedliche Materialeigenschaften können zu Unstimmigkeiten bei den mechanischen Eigenschaften, der Abbaugeschwindigkeit und der Biokompatibilität der gedruckten Konstrukte führen, was die Gesamtfunktionalität und Sicherheit beeinträchtigt. Ein weiteres Problem ist die Lebensfähigkeit und Funktionalität der im Bioprint-Verfahren hergestellten Konstrukte. Während die Forscher die Lebensfähigkeit der Zellen anstreben, gibt es Fälle, in denen der Druckprozess das Überleben und das Verhalten der eingebetteten Zellen beeinträchtigt, insbesondere aufgrund mechanischer Kräfte.
Darüber hinaus erschwert das Fehlen standardisierter Protokolle zur Charakterisierung und Bewertung von gedruckten Konstrukten die Qualitätskontrolle. Unterschiedliche Bewertungskriterien machen den Vergleich der Ergebnisse verschiedener Studien schwierig. Eine weitere große Herausforderung ist die Integration funktioneller Gefäßnetze in biologisch gedruckte Gewebe, um eine angemessene Nährstoffversorgung zu gewährleisten. Die Bemühungen um die Schaffung funktioneller Blutgefäße sind sehr komplex, was sich auf die Vaskularisierung größerer Gewebe auswirkt, und die Techniken müssen verbessert werden. Darüber hinaus werfen unterschiedliche Szenarien, wie die Erzeugung menschlicher Organe, Bedenken hinsichtlich des Eigentums an den Organen, der Zustimmung der Patienten und der rechtlichen Rahmenbedingungen auf. Dies macht umfassende ethische und rechtliche Rahmenbedingungen speziell für das Bioprinting immer notwendiger.
Zusammenfassend lässt sich sagen, dass das Bioprinting zwar Fortschritte gemacht hat, aber die Herausforderungen bei den Biomaterialien, der Lebensfähigkeit der Zellen und der Charakterisierung trotzdem zeigen, dass die derzeitigen Verfahren nicht ausreichen. Diese Herausforderungen unterstreichen, wie wichtig es ist, sich weiterhin um standardisierte Richtlinien und Protokolle zu bemühen, um die Zuverlässigkeit und Konsistenz des Bioprinting zu verbessern. Diese Beispiele unterstreichen die Komplexität des Bioprinting und die Notwendigkeit, technische, ethische und regulatorische Herausforderungen zu meistern, um allgemein akzeptierte Standards zu schaffen.
Was glauben Sie, wohin sich Bioprinting unter diesen Gesichtspunkten in den nächsten Jahren entwickeln wird? Lassen Sie uns dazu einen Kommentar da, oder teilen Sie es uns auf Facebook oder LinkedIN mit. Möchten Sie außerdem eine Zusammenfassung der wichtigsten Neuigkeiten im 3D-Druck und der additiven Fertigung direkt und bequem in Ihr Postfach erhalten? Dann registrieren Sie sich jetzt für unseren wöchentlichen Newsletter.
*Titelbildnachweis: Deep-image.ai







